水凍結乾燥法とは
走査電子顕微鏡(SEM)は真空中で試料を観察するので、水分を多く含んだ試料をそのまま観察しようとすると、試料から水分が抜けてスルメや干物のように収縮変形します。水分を含んだままの姿で観察できる低真空SEMやイオン液体を塗布する方法などもありますが、どちらも高分解能観察が苦手で、試料の長期保存ができないため、できるだけ形態を損なわずに試料を乾燥する必要があります。試料乾燥には臨界点乾燥法とt-ブチルアルコール凍結乾燥法が広く使用されていますが、有機溶媒の使用によって試料が変形しやすいため、あらかじめ蛋白質や脂質を固める有毒薬品を使用した化学固定が必須で、最適固定液の選定、浸透圧やpHの調整、濃度を変えたエタノールなどによる上昇系列脱水など、作製には長時間かかりました。Suzakiら1,2)や鈴木ら3)の試料載台の上面に試料を含んだ水を載せて液体窒素やドライアイスで試料載台を冷却して間接的に水を凍結後真空乾燥する方法は、原生生物においては従来法と比較して変形が少なく化学固定も不要な場合も多いので短時間でSEM試料作製が可能ですが、冷却速度が遅いため、結果のばらつきが大きいという問題がありました。創価大学に於ける研究の結果4-6)、水を使用した凍結乾燥法の原理が明らかとなり、-100℃に冷却した最適質量の金属ブロックを、試料を含んだ水の表面に接触して凍結速度が早くなるように改良したことなどによって再現性の良い試料作製が可能となりました。そして、この方法を水凍結乾燥法と命名しました。
水凍結乾燥法は試料を凍結する時に水のみを使用します。淡水生物は生息している環境のまま凍結されるので、化学薬品を使用する従来法よりもより自然な姿で乾燥されます。また、有機溶媒など化学薬品による試料収縮が回避できることから、近年は水性ゲルの研究にも使用されています。
水凍結乾燥法の原理
凍結によって試料が壊れる主な原因は、試料中に生ずる氷晶が大きくなって組織を破壊することによりますので、氷晶のサイズを無視できる程度に抑える必要があります。氷晶の成長を抑える方法は、急冷するか、高い圧力の下で凍結することです。水凍結乾燥法は高い圧力を利用して氷晶成長を抑えています。
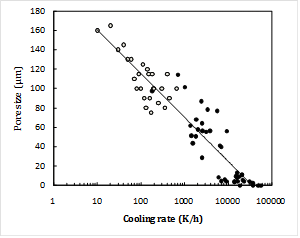
氷は水より軽くて水面に浮くことからわかるように、水には凍結すると体積が増加する特殊な性質があります。水に浸した試料を冷却して凍結するとき、生物試料の凍結温度は水の凍結温度より低温ですから、試料より先に周囲の水が凍結します。次いで試料が凍結する時、周囲を氷で固定されている試料は膨張できないので内部の圧力が増加します。圧力が増加すると水は粘度が上昇するため結晶し難くなり、試料内部の氷晶成長が抑えられます。寒天ゲルを水中に置いて凍結後、水分を真空乾燥したとき、寒天の内部で氷晶が成長するとその痕跡が残ります。それは、水は凍るとき水以外の不純物を押し出して純粋な氷となる性質があるので、押し出された寒天が氷晶の外側に集められて壁を作り、断面を観察すると蜂の巣のような穴が見え、その大きさはほぼ氷晶の大きさとなります。試料を冷やして冷凍するとき、氷晶成長を顕微鏡観察で無視できる程度に抑えるには毎秒105Kの速度で冷却しなければならないとされていました。下図4)は、水の中に寒天ゲルを置いて冷却速度を変えて凍結後真空乾燥し、横軸に冷却速度、寒天内部に生じた穴の大きさを縦軸に示したものです。これから、毎秒約10Kで冷却すると観察できるサイズの氷晶は生じないことがわかりました。冷却した金属ブロックを、試料を含んだ水の表面に直接接触すると、水の深さが1mm程度までなら試料を毎秒10K以上の速度で冷却することができます。
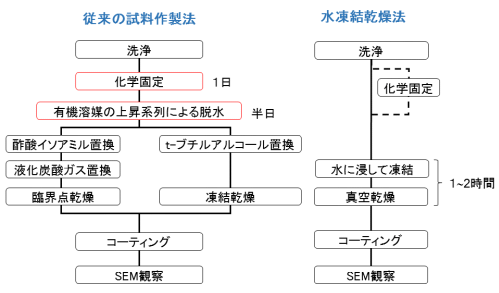
下図は従来の方法と水凍結乾燥の手順を比較したものです。
水凍結割断
水凍結乾燥法の開発過程で、新しい割断試料の作製法が考案されました4)。低真空SEM凍結乾燥法は液体窒素で冷却して凍結するので、冷却過程で氷内部に生じた大きな温度差によって氷が割れて同時に試料が割れることがあります。氷と試料がともに割れてきれいな断面が得られることを利用して、積極的に試料を閉じ込めた氷を割って試料断面を作製する割断器が開発されました。従来のDEMSOやアルコール中に試料を入れて液体窒素で凍結後割断する方法は、特定部位を狙っての割断が困難でしたが、水凍結割断法は実体顕微鏡下で割断位置を調整して凍結割断を行うことによって、狙った位置に対して±0.04~0.1mm程度のずれで割断することができるようになりました。常圧下での凍結割断は1mm以下のサイズに限定されますが、水が凍結する際の圧力上昇がより大きくなるようにして、より大きな水性ゲル試料の断面を得る試みもなされています10)。
1) Suzaki, T., Y. Shigenaka, A. Toyohara and H. Otsuji (1978): A simplified
freeze-drying technique for protozoan cells. Journal of Electron Microscopy,
27(2): 153-156.
2) Suzaki, T., Y. Shigenaka, S. Watanabe and A. Toyohara (1980): Food capture
and ingestion in the large heliozoan, Echinosphaerium Nucleofilm. Journal
of Cell Science, 42: 61-79.
3) 鈴木武雄, 柴田昌照, 田中和明, 土田恵子, 戸田龍樹.(1995). 低真空走査型電子顕微鏡を利用したプランクトン観察のための新しい凍結乾燥法とその応用.
日本プランクトン学会報. 42(1): 53-62.
4) 太田裕彦、阿部数馬、鈴木武雄、戸田龍樹、桑田正彦.(2011).冷却した水を使用した新しいSEM試料作製用凍結乾燥法.医生電顕技術誌.25(1):9-13.
5) 阿部数馬, 佐藤正紀, 太田裕彦, 桑田正彦.(2011). イオン液体の水凍結割断法への応用.医生電顕技術誌.25(1):5-8.
6) 太田裕彦, 穂積将男, 桑田正彦. (2012). 水凍結乾燥法の凍結過程における圧力の効果. 医生電顕技術誌. 26(2): 1-2.
7) Noriaki Natori, Masahiko Kuwata, Takeo Suzuki, Tatsuki Toda (2017).Limnol. Oceanogr. Methods. A novel fracturing device to observe the gut contents of copepod
nauplii using a scanning electron microscope. 15:567-571.
8) 桑田正彦・田中和明・鈴木武雄・名取則明・戸田龍樹(2018): 水凍結乾燥法を用いた淡水産微小生物のSEM試料作製と観察-1(藍藻類).陸水学雑誌,79:109-116.
9) 桑田正彦・名取則明・戸田龍樹・田中和明・鈴木武雄 (2019):水凍結乾燥法を用いた淡水産微小生物のSEM試料作製と観察-2(原生生物).陸水学雑誌,80:73–82.
10) Hirofumi Satani, Masahiko Kuwata, Hirotaka Ishii, Toshifumi Inoue,
Akio Shimizu (2021). High Pressure Research. Preparation of SEM hydrogel
samples using a high pressure water freeze fracture method. 41: 97-108.